-
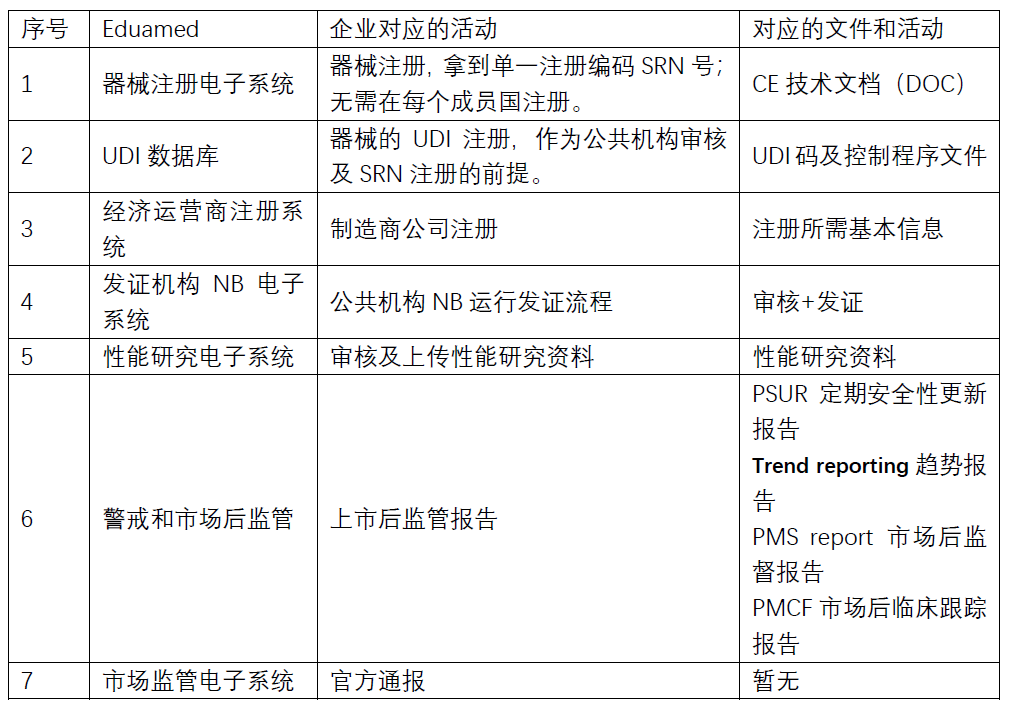
01CE技術(shù)文檔
使用國際公認(rèn)的醫(yī)療器械命名
參考附錄II技術(shù)文件
新涵蓋UDI 編碼文件
風(fēng)險(xiǎn)系統(tǒng)文件
性能評估和和上市后跟蹤文件(PMPF)
CE技術(shù)文檔A部分上報(bào)后獲得單一注冊號SRN
-
02UDI 技術(shù)文檔
DI 器械標(biāo)識
PI生產(chǎn)標(biāo)識
UDI-DI部分要提交于系統(tǒng)和給NB機(jī)構(gòu)。上市后監(jiān)管和不良事件處理都要涉及UDI。UDI在UDI數(shù)據(jù)庫注冊后獲得注冊號。UDI還要體現(xiàn)在自由銷>售證書FSC和CE自我申明DoC中。
-
03企業(yè)文檔
涉及企業(yè)注冊各種報(bào)表填寫,具體由官方數(shù)據(jù)庫規(guī)定。一般來說跟CE技術(shù)文檔的A部分類似。
-
04質(zhì)量管理體系
(a) 法規(guī)符合性戰(zhàn)略,包括符合性評估流程的遵守和系統(tǒng)所涵蓋的器械的變更管理;
(b) 確定適用的通用安全與性能要求,尋找滿足這些要求的選項(xiàng);
(c) 管理責(zé)任;
(d) 資源管理,包括選擇和管理供應(yīng)商和分包商;
(e) 附錄I第3節(jié)規(guī)定的風(fēng)險(xiǎn)管理;
(f) 性能評估,根據(jù)第56條和附錄XIII的規(guī)定,包括上市后的性能追蹤;
(g) 產(chǎn)品實(shí)現(xiàn)規(guī)劃,包括規(guī)劃、設(shè)計(jì)、研發(fā)、生產(chǎn)和服務(wù)提供;
(h) 根據(jù)第24(3)條為所有相關(guān)器械的UDI分配驗(yàn)證,并確保根據(jù)第26條提供的信息的一致性和有效性;
(i) 根據(jù)第78條的要求,建立、實(shí)施和維護(hù)上市后監(jiān)管體系;
(j) 與主管機(jī)構(gòu)、公告機(jī)構(gòu)、其他經(jīng)濟(jì)運(yùn)營商、客戶和/或其他利益相關(guān)人溝通;
(k) 警戒情況下的嚴(yán)重事件和現(xiàn)場安全糾正措施的報(bào)告流程;
(l) 糾正措施和預(yù)防措施的管理及其有效性的驗(yàn)證;
(m) 產(chǎn)品,數(shù)據(jù)分析和產(chǎn)品改進(jìn)的監(jiān)督和評估流程。
-
05風(fēng)險(xiǎn)管理體系
風(fēng)險(xiǎn)評估中應(yīng)包含:技術(shù)更新風(fēng)險(xiǎn)評估,現(xiàn)場安全糾正措施風(fēng)險(xiǎn)評估,臨床效益風(fēng)險(xiǎn)評估。
有貫穿整個(gè)生命周期的風(fēng)險(xiǎn)管理體系。風(fēng)險(xiǎn)管理建立后第一年更新,隨后每兩年一更新。要符合持續(xù)合規(guī)。
-
06上市后監(jiān)管體系
上市后監(jiān)管計(jì)劃,涵蓋:警戒系統(tǒng)、技術(shù)升級風(fēng)險(xiǎn)評估、現(xiàn)場通告,現(xiàn)場糾正措施、主動(dòng)收集售后投訴和舉報(bào)、臨床風(fēng)險(xiǎn)跟蹤措施,PMPF(上市后性能跟蹤)、性能評估、不合格召回
-
07倫理審批
A,B類器械不需要到歐盟做臨床性能評估,C,D類需要去歐盟做臨床性能評估。
剩余樣本臨床性能評估計(jì)劃無須歐盟審批,但需要倫理審批。需要滿足《赫爾辛基宣言》。臨床計(jì)劃應(yīng)符合ISO14155。
-
08研究計(jì)劃
C,D類在歐盟參考實(shí)驗(yàn)室依據(jù)CS做性能評估(分析,診斷靈敏度等項(xiàng)目)是臨床研究的前提。
需要提交研究計(jì)劃到歐盟數(shù)據(jù)庫,剩余樣本研究不需要審批,但研究計(jì)劃更改和變更需要審批。臨床研究結(jié)束后或暫停后三個(gè)月內(nèi)需要提交結(jié)果總結(jié),研究報(bào)告。
-
09臨床證據(jù)
包含:性能評估(分析性能+臨床性能)、科學(xué)數(shù)據(jù)(技術(shù)文件)、臨床性能(需驗(yàn)證交叉,干擾)、PMPF(上市后性能追蹤)、效益風(fēng)險(xiǎn)評估
-
10PSUR(定期安全性更新報(bào)告)
C類和D類器械的制造商應(yīng)編制定期安全性更新報(bào)告(“PSUR”)
PSUR應(yīng)列出:
(a) 效益風(fēng)險(xiǎn)監(jiān)測的結(jié)論;
(b) 上市后性能跟蹤報(bào)告(PMPF)的主要結(jié)果;
(c) 器械的銷售量和使用器械的群體規(guī)模與其他特性的評估,以及實(shí)際運(yùn)行時(shí)器械的使用頻率。
C類和D類器械的制造商應(yīng)至少每年對PSUR進(jìn)行更新。PSUR應(yīng)屬于附錄II和III中所規(guī)定技術(shù)文件中的一部分。
C類器械制造商應(yīng)向參與符合性評估的公告機(jī)構(gòu)提交PSUR,并應(yīng)主管機(jī)構(gòu)要求向其提供報(bào)告
嚴(yán)重事件和現(xiàn)場安全糾正措施的報(bào)告和現(xiàn)場安全通告,以及提供定期匯總報(bào)告、上市后監(jiān)管報(bào)告、定期安全性更新報(bào)告(PSUR)以及趨勢報(bào)告;
-
11趨勢報(bào)告
向相關(guān)主管機(jī)構(gòu)報(bào)告以下內(nèi)容:
(a) 任何涉及在歐盟市場上所提供器械的嚴(yán)重事件,除了在產(chǎn)品信息和技術(shù)文件中清楚記錄并量化的預(yù)期錯(cuò)誤結(jié)果,此類事件應(yīng)根據(jù)第83條進(jìn)行趨勢報(bào)告
(b) 報(bào)告現(xiàn)場安全糾正措施、制造商提供定期匯總報(bào)告和趨勢報(bào)告的時(shí)間表;
-
12PMPF
上市后性能追蹤(PMPF)
參見附錄XIII 性能評估、性能研究和上市后跟蹤(PMPF)
PMPF計(jì)劃應(yīng)至少包括:
(a) 應(yīng)用PMPF的一般方法和流程,如收集獲得的臨床經(jīng)驗(yàn)、使用者反饋、科學(xué)文獻(xiàn)篩選和其他性能或科學(xué)數(shù)據(jù)來源;
(b) 應(yīng)用PMPF的具體方法和流程(例如,環(huán)形比對試驗(yàn)和其他質(zhì)量保證活動(dòng)、流行病學(xué)研究、合適的患者評估或疾病登記、遺傳數(shù)據(jù)庫或上市后臨床性能研究);
(c) (a)和(b)中所述的方法和流程適當(dāng)性的理由;
(d) 參考本附錄A部分第1.3節(jié)所所述的性能評估報(bào)告的相關(guān)部分以及附錄I
第3節(jié)所述的風(fēng)險(xiǎn)管理;
(e) PMPF要解決的具體目標(biāo);
(f) 與等效或類似器械相關(guān)的性能數(shù)據(jù)評估,以及技術(shù)發(fā)展最新水平;
(g) 參考制造商使用的所有CS、協(xié)調(diào)標(biāo)準(zhǔn)和相關(guān)PMPF指南;
(h) 由制造商進(jìn)行的PMPF活動(dòng)的詳細(xì)且充分合理的時(shí)間表(例如,PMPF數(shù)據(jù)和報(bào)告分析)。
-
13不良事件報(bào)告
UDI用于報(bào)告嚴(yán)重不良事件及現(xiàn)場安全糾正措施
臨床性能研究生成唯一的標(biāo)識號用于報(bào)告嚴(yán)重不良事件及現(xiàn)場安全糾正措施
性能研究中:申辦方應(yīng)充分記錄以下所有情況:
(a) 在性能研究計(jì)劃中發(fā)現(xiàn)對性能研究結(jié)果的評估至關(guān)重要的任何不良事件類型;
(b) 任何嚴(yán)重不良事件;
(c) 任何如未采取適當(dāng)措施、未發(fā)生干預(yù)或情況不利時(shí),可能導(dǎo)致嚴(yán)重不良事件的器械缺陷;
-
14CE證書的簽發(fā)
D類器械由NB審批+政府審批。
D類器械實(shí)行批批簽。
B,C類器械由NB審核發(fā)證。
D類器械由歐盟參考實(shí)驗(yàn)室進(jìn)行性能驗(yàn)證。
性能驗(yàn)證涵蓋(分析性能+安全性能)分析性能驗(yàn)證計(jì)劃需涵蓋:原理,目的,方法,檢測,統(tǒng)計(jì),并可執(zhí)行。
B,C類器械由通告機(jī)構(gòu)驗(yàn)證
A類企業(yè)自行驗(yàn)證
B類技術(shù)文件的審批參照附錄IX 4.4-4.8和附錄I和附錄II。涵蓋:CS,協(xié)調(diào)標(biāo)準(zhǔn),性能評估,溯源,培訓(xùn),PMPF,風(fēng)險(xiǎn),警戒等。
加強(qiáng)質(zhì)量管理體系飛行檢查。
B,C類需要審核《趨勢報(bào)告》
證書提交于證書系統(tǒng)數(shù)據(jù)庫。
CE證書是準(zhǔn)許上市和獲得FSC的前提。
-
15自由銷售證書FSC
自由銷售證書應(yīng)列明器械基本UDI-DI。自由銷售證書應(yīng)列出公告機(jī)構(gòu)簽發(fā)的唯一識別號以標(biāo)識此證書。自由銷售證書,應(yīng)制造商或授權(quán)代表要求,制造商或授權(quán)代表注冊地所在成員國需簽發(fā)一份自由銷售證書。
-
16分類規(guī)則
參考附錄VIII





 獲取更多資訊
獲取更多資訊
